
再生医療を国民が安全に迅速に受けられるようするために、再生医療等の安全性の確保等に関する法律(以降、再生医療等安全性確保法と記す)の施行から5年を経ました。厚生労働省は施行後5年を目処とした検討を行い、論点整理をし、これまでに明確な法的な位置づけがされていなかったゲノム編集技術を用いた医療について、第一種再生医療等に位置付ける方針を明らかにしました1)。
4.遺伝子治療の状況
4.1 遺伝子治療の実態調査
厚生労働省は遺伝子治療(治療・研究)の実態を確認するために、国内外の医療機関における遺伝子治療の実態についてWeb調査を実施しました(2018年11月~2019年3月)2)。その結果、国内で自由診療として行われているin vivo遺伝子治療注1)の件数は66件でした。1994年以降に、国内で申請された遺伝子治療等臨床研究・治験数は56件です。対象疾患ががんであることが明記されているのは45件で、残りの21件は対象疾患が明記されていなかったとしています。
4.2 再生医療と遺伝子治療の規制
対象技術として、細胞、細胞・遺伝子(ex vivo遺伝子治療注2))を使う場合は、研究、診療は再生医療等安全性確保法によって規制を受けます。遺伝子治療等で遺伝子(in vivo遺伝子)においては、臨床研究は遺伝子治療等臨床研究に関する指針・臨床研究法によって規制を受けますが、自由診療として行われる場合については規制はありません2)。これは再生医療等安全性確保法においては、細胞加工物を用いる医療が規制の対象となっていることに基づきます。
4.3 ゲノム編集技術
再生医療等安全性確保法では、遺伝子導入を行わずに遺伝子操作を加える技術(ゲノム編集技術)を用いた再生医療等技術は、第一種再生医療等技術注3)に含まれず、第三種再生医療等技術に分類されます。厚生労働省は遺伝子導入を行わずに遺伝子操作を加える再生医療等技術の安全性評価指標の構築に関する研究(2018年度厚生労働科学特別研究事業)を実施しました。その結果、ゲノム編集技術については臨床経験がまだ十分ではありませんが、文献調査に基づく報告からは、オフターゲット作用(標的とする配列以外のゲノム領域に意図しない突然変異が導入されることで生じる作用)によるがん遺伝子変異の可能性や、従来とは異なる染色体切断に伴う発がんのリスクが示唆されたとのことです。これらを鑑みて、ゲノム編集技術についても、従来の遺伝子導入技術と同様、第一種再生医療等技術として整理されるべきであるとの結論を得たとしています。
4.4 再びin vivo遺伝子治療に対する規制について3)
in vivo遺伝子治療は、細胞の加工を伴いませんから、再生医療等安全性確保法の対象外です。臨床研究は臨床研究法及び遺伝子治療等臨床研究に関する指針による一定の手続き規制の下、実施が可能となります。自由診療として行われる場合には法による規制はありません。治験・製造販売を行う場合は、医薬品医療機器等法により、一定の手続規制の下、実施が可能です。
in vivo遺伝子治療の危険性については、使用するウイルス等や遺伝子操作に関する安全面や倫理面の課題、遺伝子操作による後世への遺伝的影響、用いるウイルス等による周囲環境への影響が考えられます。日本遺伝子細胞治療学会は、医薬品医療機器等法に合わせて、再生医療等安全性確保法にin vivo遺伝子治療を取り込むべきである、ex vivo遺伝子治療とin vivo遺伝子治療に対する規制の程度を分ける合理性はないとの意見表明をされています。
5.ゲノム編集、第一種再生医療等技術へ
前記状況を踏まえ、厚生労働省はゲノム編集技術を使った医療について、2020年3月2日、再生医療安全性確保法のヒトに未実施な高リスクで審査が厳しい第一種再生医療等技術(iPS細胞、ES細胞、他家細胞を用いた医療技術、ex vivo遺伝子治療など)に位置づける方針を示しました4)。
再生医療等の安全性の確保等に関する法律施行規則(平成26年厚生労働省令第110号)第2条第2号を改正し、第一種再生医療等技術として、「遺伝子を改変する操作を行った細胞又は当該細胞に培養その他の加工を施したものを用いる医療技術」を追加することになりました。これにより、提供する医療機関が事前に提出した計画について、厚生労働省の厚生科学審議会から安全性に問題がないかなど評価を受ける必要があります。
図1は体細胞遺伝的改変に関する法的規制について参考資料5)に基づき、図2は再生医療と遺伝子治療の規制に関して参考資料2)を参考に、図3は再生医療の実用化を促進する制度的枠組みに対して参考資料2)よりまとめました。
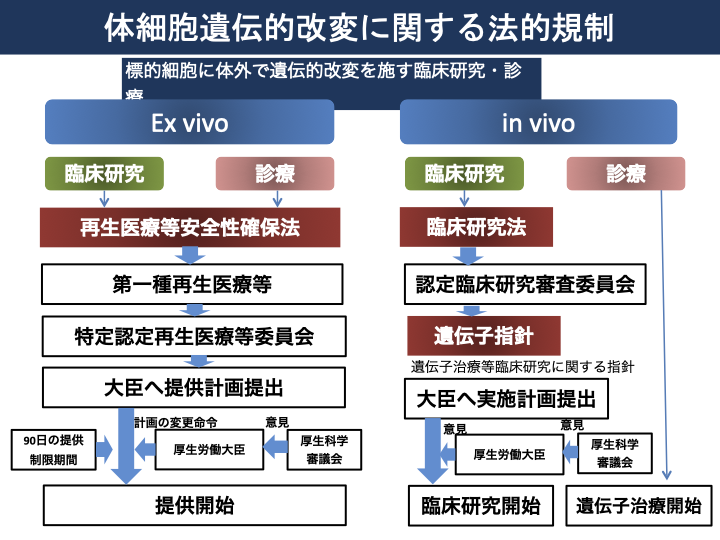
図1 体細胞遺伝的改変に関する法的規制5)
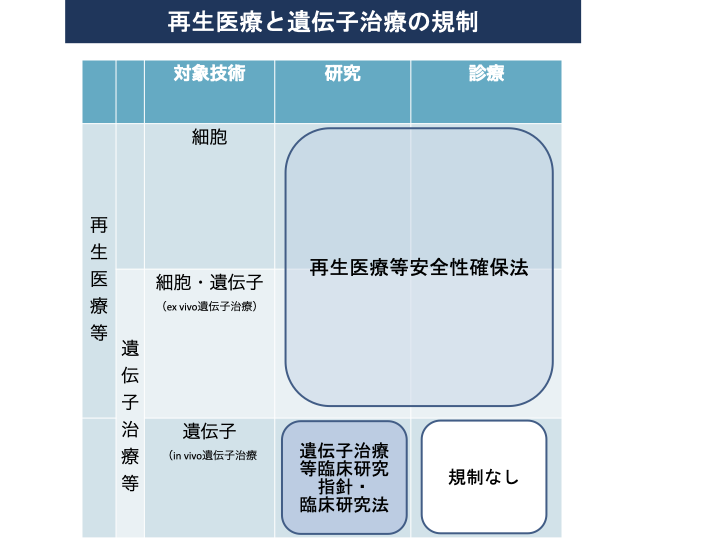
図2 再生医療と遺伝子治療の規制2)
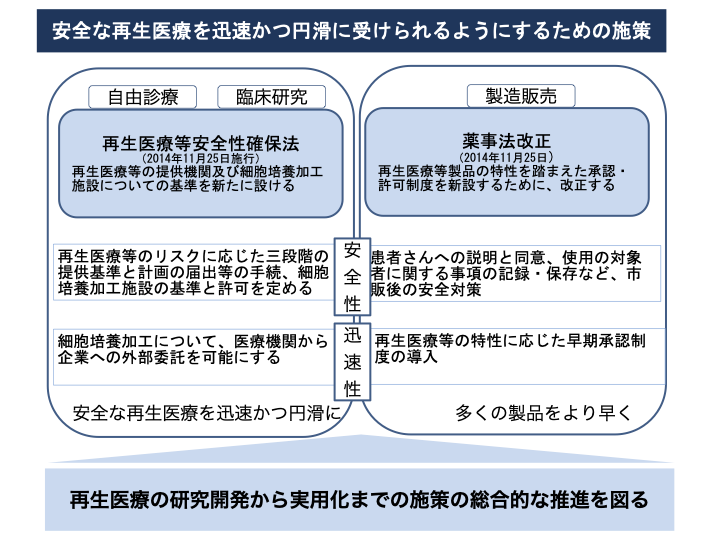
図3 再生医療の実用化を促進する制度的枠組み2)
(用語解説)
(参考資料)
(NPO法人再生医療推進センター 守屋好文)
プライバシーポリシー
再生医療推進センターは再生医学、再生医療の実用化を通して社会への貢献を目指す非営利活動法人です。
Copyright © NPO法人再生医療推進センター All rights reserved.